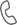Методы хирургического лечения глаукомы
Распространенность
По данным ВОЗ, в настоящее время количество страдающих глаукомой в мире доходит до 80–100 млн человек.
К 2020 году показатель может увеличится на 10 млн человек.
К 2030 г. по данным ряда исследований данный показатель может увеличится в два раза.
Несмотря на высокую распространенность заболевания, лишь половина страдающих глаукомой знает о своем диагнозе и получает адекватное лечение на ранних сроках заболевания.
Первичная глаукома имеет три основные формы: закрытоугольная, открытоугольная (ПОУГ) и смешанная. Вне зависимости от формы глаукомы основным фактором, который определяет риск поражения зрительного нерва, является высокое внутриглазное давление (ВГД). Достижение целевого ВГД предотвращает потерю зрительных функций и является основным показанием как медикаментозного, так и для хирургического вмешательств.
При отсутствии стабилизации ВГД в условиях максимального режима медикаментозного лечения и (или) при низкой комплаентности (приверженности) пациента назначенному лечению прибегают к хирургическому или лазерному лечению глаукомы.
Цель оперативных вмешательств- не улучшение зрительных функций, а сохранение имеющегося зрения за счет снижения и стабилизации ВГД.
Для понимания принципов оперативных вмешательств при глаукоме необходимо знать основные особенности оттока внутриглазной жидкости в глазу
ГИДРОДИНАМИКА ГЛАЗА
Внутриглазная жидкость (ВГЖ) продуцируется отростками цилиарного тела. Далее она накапливается в задней камере глаза, откуда через зрачок попадает в переднюю камеру глаза.
Существуют следующие путти оттока ВГЖ из передней камеры (рисунок 1):
- Трабекулярный путь оттока ВГЖ.
Передняя камера →трабекулярный аппарат → шлеммов канал →выводящие коллекторы канала Шлемма → эписклеральные вены→ передние цилиарные вены.
В связи с тем, что данным способом оттекает около 85% всей ВГЖ, основные операционные манипуляции направлены на улучшение именно данного пути оттока.
- Увеосклеральный путь оттока ВГЖ (5-15 % всей ВГЖ).
- Дренаж через радужку (порция дренируемой ВГЖ незначительна).
Увеальная порция трабекулы → цилиарное тело → супрацилиарное и супрахориоидальное пространства →склеральные эмиссарии→ лимфатические сосуды и вены орбиты.
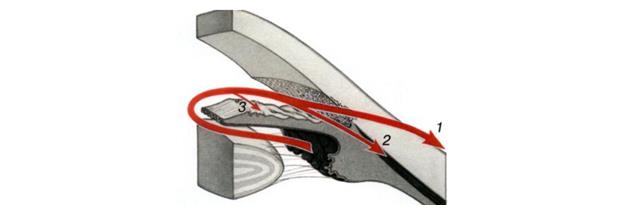
Рисунок 1 – передние пути оттока ВГД
(1- трабекулярный, 2 – увеосклеральный 3- дренаж через радужку)
4. Задний путь оттока (порция дренируемой ВГЖ незначительна)
Стекловидное тело → Периневральные пространства зрительного нерва и периваскулярные пространства ретинальной сосудистой системы.
Хирургические вмешательства при глаукоме можно разделить на три разновидности:
А) Направленные на образование новых путей оттока (иридэктомия, синустрабекулэктомия, глубокая склерэктомия, имплантация дренажных устройств)
Б) Направленные на улучшение оттока по естественным путям (вискоканалостомия, каналопластика, гониотомия, трабекулотомия)
В) Направленные на снижение продукции внутриглазной жидкости (циклокриотерапия, Nd: Yag laser циклодеструкция, Diode laser циклофотокоагуляция)
Европейское глаукомное общество советует применять следующие типы хирургических вмешательств:
- гониотомия и трабекулотомия – для лечения врожденной глаукомы;
- синустрабекулэктомия – операция первого выбора для больных с первичной открытоугольной и псевдоэксфолиативной глаукомой;
- непроникающие операции могут быть выполнены, когда «давление цели» является не слишком низким (лучше при I стадии ПОУГ);
- использование дренажных трубочек рекомендовано при неэффективности фистулизирующих операций;
- циклодеструктивные операции рекомендуется выполнять для лечения больных с плохим прогнозом для сохранения зрительных функций.
Хирургическое лечение является первым методом выбора только при врожденной глаукоме и глаукоме со зрачковым блоком.
В остальных случаях лечение глаукомы остается «трехкомпонентным»: медикаментозным, лазерным и хирургическим.
Существует большое количество различных методик хирургического лечения глаукомы, а также их модификаций. В данной статье описаны наиболее распространенные варианты. Способ хирургического вмешательства определяется в каждом конкретном случае индивидуально.
Ⅰ Иридэктомия
Историческая справка: Иридэктомия –первый метод хирургического лечения глаукомы. Впервые произведена в 1857 г A. Graefe. На протяжении почти 50 лет была единственным способом хирургического лечения пациентов с глаукомой.
Ход операции. Выполнение разреза у лимба, захват и разрез периферической части радужки (рисунок 2) [1].
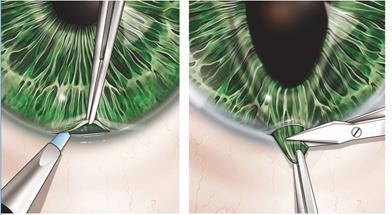

Рисунок 2 – Основные этапы иридэктомии.
В результате операции формируется отверстие в радужной оболочке, что способствует улучшению оттока внутриглазной жидкости из задней камеры в переднюю при зрачковом блоке.
Новый путь оттока: задняя камера → отверстие в радужной оболочке → передняя камера (рисунок 3) [1].
Рисунок 3 – Новый путь оттока из задней камеры в переднюю при зрачковом блоке через отверстие в радужной оболочке (отображен стрелками)
В настоящее время формирование отверстия в радужной оболочке возможно с помощью менее инвазивной технологии - лазерной иридотомии (с Nd: YAG или аргоновым лазером). Классическая иридэктомия как хирургический метод используется в случае невозможности проведения лазерной иридотомии или как один из этапов других хирургических вмешательств (например, синустрабекулэктомии).
Ⅱ ФИСТУЛИЗИРУЮЩИЕ ОПЕРАЦИИ
Историческая справка.В 1887 А. М. Маклаков предложил первую фистулизирующую операцию, которую он назвал косой склеротомией. Однако лишь с 1906 г фистулизирующие операции стали широко использоваться при лечении глауком (корнео-склеральная трепанация по Эллиоту в 1906 г. и ириденклейз по Гольту в 1907 г.).
К фистулизирующим операциям при ПОУГ относится метод глубокой склерэктомии, основанный на формировании поверхностного и глубокого лоскутов склеры с иссечением последнего. В таком случае дополнительный отток ВГЖ осуществляется через фенестры в эпителии капилляров цилиарного тела и по супрахориоидальному пространству, а также в сосуды конъюнктивы.
В настоящее время глубокая склерэктомия выполняется редко, т.к. чаще выбор хирургов падает на «золотой стандарт» хирургического лечения глаукомы – синустрабекулэктомию.
Ⅱа СИНУСТРАБЕКУЛЭКТОМИЯ
Историческая справка: метод разработан в 1968 г. J.E. Cairns [2]
Синонимы: трабекулоканалэктомия, синусотрабекулэктомия, секторная синусэктомия, субсклеральная склерэктомия, склерокератэктомия
Синустрабекулэктомия (СТЭ) - «золотой стандарт» в хирургии ПОУГ, получила широкое распространение в мире при различных формах глаукомы вследствие достаточно высокого эффекта, простой техники выполнения и умеренного числа осложнений [3-5]
Принцип методики: Выполнение СТЭ позволяет снизить ВГД путем увеличения оттока водянистой влаги из передней камеры. Создается дополнительный путь оттока через отверстие в стенке склеры в субтеноново пространство.
Ход операции. После освобождения эписклерального пространства производят разрез склеры на 2/3 ее толщины треугольной или прямоугольной формы, а затем отсепаровывают данный лоскут до прозрачной роговицы (рисунок 4) [1]. Таким образом формируется склеральный лоскут и склеральное ложе. Выполняется парацентез в верхне-височном квадрате (для восстановления в последующем передней камеры).
Рисунок 4- Формирование лоскута склеры
Путем удаления части склеры , канала Шлемма и трабекулярной сети достигается передняя камера глаза. (рисунок 5) [1].
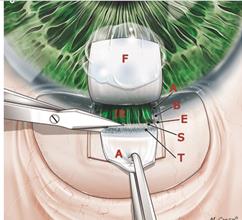
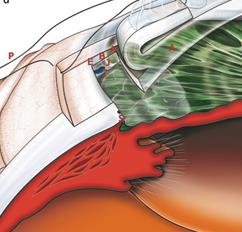
Рисунок 5- Удаление части склеры, шлеммова канала, трабекулярной сети
(F - перевернутый склеральный лоскут, A - прозрачная роговица, S - склеральная шпора, E-поверхностный ориентир склеральной шпоры, T – трабекулярная сеть)
Выполняется базальная иридэктомия – удаление наружного края радужки с целью профилактики «выпадания» радужной оболочки из внутреннего склерального отверстия и формирования блока (рисунок 6) [1].
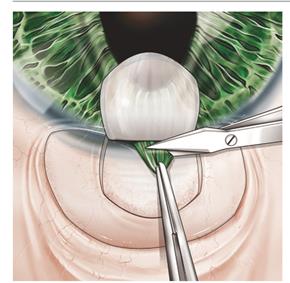
Рисунок 6 – Выполнение базальной иридэктомии
Склеральный лоскут укладывается на сформированное ложе и свободно фиксируется в дистальных углах.
Новый путь оттока: задняя камера → отверстие в радужной оболочке → передняя камера → удаленная часть склеры , канала Шлемма и трабекулярной сети →фильтрационная подушка (субтеноново пространство) (рисунок 7) [1].
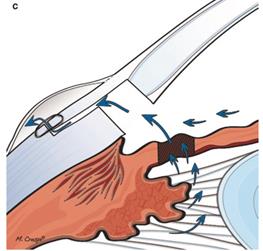
Рисунок 7 – Новый путь оттока, сформированный после СТЭ
Существуют различные модификации данного оперативного вмешательства, например трепанотрабекулоэктомия и метод дополнительного глубокого вскрытия склеры [6,7].
Несмотря на то, что СТЭ является в настоящее время является «золотым стандартом» оперативного вмешательства при глаукоме, в послеоперационном периоде возможно развитие следующих осложнений [8,9]:
- снижение нормального уровня ВГД как результат чрезмерной фильтрации через зону склерального лоскута при его недостаточной адаптации. Гипотония также может свидетельствовать о таком грозном осложнении, как цилиохориоидальная отслойка;
- синдром мелкой передней камеры (как результат гиперфильтрации);
- повышение ВГД в результате недостаточной фильтрации (экстрасклеральный, субконъюнктивальный фиброз, блокада фистулы избыточным натяжением склерального лоскута и др.);
- прогрессирование катаракты;
- развитие гифемы;
- эндофтальмит.
Тактика уменьшения количества послеоперационных осложнений
Наиболее высокий интерес вызывают методы, снижающие риск развития рубцевания в послеоперационном периоде. Так, для повышения эффективности СТЭ предлагается применение антиметаболитов, ингибирующих пролиферацию фибробластов: митомицина –С или 5-фторурацила. Обладая цитостастическим действием данные вещества вызывают такие осложнения, как роговичная эпителиопатия, хроническая гипотония и формирование наружной фистулы, в связи с чем их применение строго ограничено.
Некоторые авторы предлагают использование коллагеновых матриц и биоразлагаемых спейсеров для предотвращения образования рубцов. В 2010 году кафедрой офтальмологии ГУО «Белорусской медицинской академии последипломного образования» был предложен метод интра и экстрасклеральной амниопластики для снижения риска послеоперационного рубцевания и профилактики осложнений [10].
В результате поиска оперативных вмешательств, которые наряду с сохранением выраженного гипотензивного эффекта, были бы максимально свободны от недостатков и осложнений, присущих СТЭ, была предложена группа непроникающих фильтрационных вмешательств
Ⅲ НЕПРОНИКАЮЩИЕ ФИЛЬТРАЦИОННЫЕ ВМЕШАТЕЛЬСТВА
История : Принцип, лежащий в основе методов, был впервые предложен Циммерманом, который использовал термин abexternotrabeculectomy для его описания [11].
К непроникающим фильтрационным вмешательствам относятся: вискоканалостомия, непроникающая глубокая склерэктомия, каналопластика.
Принцип методик. Отток внутриглазной жидкости из передней камеры глаза впервые осуществляется без нарушения целостности передней камеры благодаря естественной проницаемости для влаги периферического участка десцеметовой мембраны. Вследствие того, что в процессе выполнения хирургических манипуляций не нарушается целостность глазного яблока, риск инфекционных осложнений в течение реабилитационного послеоперационного периода сведен к минимуму.
ⅢА ВИСКОКАНАЛОСТОМИЯ
История: Впервые был описан Робертом Стегманом [13]
Ход операции. Проходит в несколько этапов:
-идентификация и расширение с использованием вискоэластичного препарата шлеммова канала (рисунок 8) [1],
-удаление десцементовой оболочки (рисунок 9) [1],
-формирование интрасклерального «озера» для обеспечения оттока водянитой влаги. При этом хирург удаляет кусочек склеры, после чего остается только тонкий слой ткани, через который происходит фильтрация внутриглазной жидкости. (рисунок 10) [1].
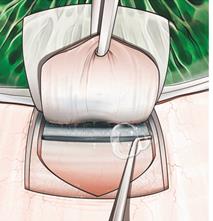
Рисунок 8 -Выделен поверхностный и глубоки склеральный лоскут.
В шлеммов канал вводится вискоэластик
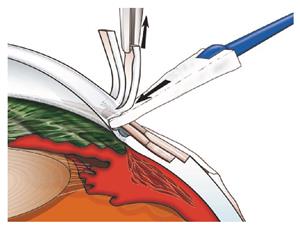
Рисунок 9 - Формирование окна в десцементовой оболочке
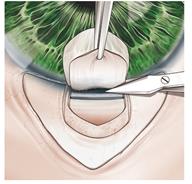
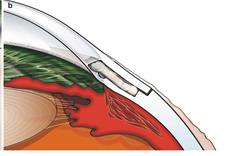
Рисунок 10 – Удаление глубокого склерального лоскута. Поверхностный лоскут укладывается на ложе, прочно фиксируется – формируется склеральное озеро.
В результате оперативного вмешательства отток жидкости: передняя камера → «окно» в десцементовой оболочке →склеральное озеро → шлеммов канал. Вода, собранная в озере, может также стечь в нижнюю сосудистую оболочку, увеличивая увео-склеральный путь оттока
(рисунок 11) [1]

Рисунок 11- Отток жидкости после проведения вискоканалостомии
! Субконъюнктивального фильтрующего пузыря не образуется, т.к. верхняя склеральная пластинка плотно закрыта.
Хотя имеются данные об относительно низком гипотензивном эффекте этой операции, после нее отмечается меньшее количество осложнений по сравнению со СТЭ [13].
Ⅲ Б НЕПРОНИКАЮЩАЯ ГЛУБОКАЯ СКЛЕРЭКТОМИЯ
Историческая справка: Впервые выполнена Федоровым в 1982 г. и Козловым в 1987 [14, 15].
Ход операции. Процедура включает удаление части склеры, включая наружную стенку канала Шлемма, и более переднюю часть, которая находится непосредственно над десцеметовой мембраной. Для нормализации офтальмотонуса, дополнительно освобождается лимбальный край десцеметовой оболочки, которая и принимает на себя основную часть оттока жидкости. (рисунок 12) [1].
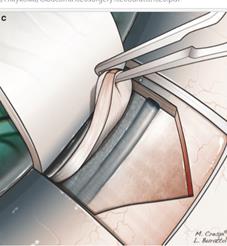
Рисунок 12 – Непроникающая глубокая склерэктомия
В результате оперативного вмешательства сформирован следующий новый путь оттока жидкости: передняя камера → интрасклеральное озеро →субтеноново пространство (рисунок 13) [1].
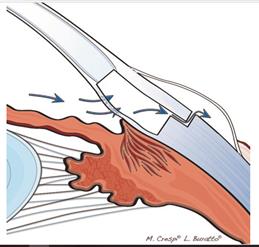
Рисунок 13 – Новый путь оттока ВГЖ из передней камеры после глубокой непроникающей склерэктомии
Ⅲ В КАНАЛОПЛАСТИКА
История :Первые сообщения о возможности канализации канала Шлемма с шелковым швом для частичной трабекулотомии опубликованы Р. Смитом в 1960 г. [16].
Прогресс в науке и технике позволил хирургам использовать гибкие микрокатетеры (iTrack, iScience Interventional, USA; Glaucolight, DORC, Netherlands) для атравматического хода по всей длине ШК с последующим стягиванием полипропиленовой нитью 10-0 для восстановления естественного оттока ВГЖ. Данная техника получила название «каналопластика» и используется в мире с 2008 г.
Ход операции. Каналопластика является модификацией метода вискоканалостомии. Однако при выполнении данного хирургического вмешательства после выделения глубокого и поверхностного склеральных локутов и выделения канала Шлемма:
1.Проводят дилатацию канала с помощью катетера;
2. В растянутом канале размещают постоянный шов
Преимущества непроникающих фильтрационных вмешательств.
Связаны с меньшей инвазивностью ( операции выполняются без проникновения в переднюю камеру):
-их использование позволяет расширить показания к раннему хирургическому лечению
-ниже риск развития осложнений
-повышают эффективность естественного пути оттока ВГЖ
Благодаря щадящей технике операции резко снизился риск возникновения интра- и послеоперационных макроперфорирующих осложнений, таких как гифема, резкое обмельчание передней камеры, экспульсивная геморрагия, отслойка сосудистой оболочки и т. д.
Недостатки непроникающих фильтрационных вмешательств:
-Эффективность операций непроникающего типа снижается в позднем послеоперационном периоде до 40-55% из-за рубцевания в зоне вновь сформированных путей.
-Часто в связи с низким гипотензивным эффектом требуется повторное проведение оперативного вмешательства.
-Эффективность операций при развитых стадиях глаукомы крайне низка.
-Техническая сложность операций:
А) Обязателен тщательный подбор пациентов с выполнением провокационной гониоскопии (для выполнения каналопластики)[17];
Б) В некоторых случаях оперативное вмешательство невозможно в связи с непроходимостью шлеммова канала [17];
- В связи с технической сложностью выполнения операций высок риск развития интраоперационных осложнений (например, перфорация ШК и миграция катетера в супрахориоидальное пространство, гифема).
Наличие большого числа способов повышения эффективности непроникающих операций свидетельствует об отсутствии удовлетворения хирургов их результатами. Поэтому исследования в этом направлении следует считать актуальными и перспективными.
Ⅳ ДРЕНАЖНЫЕ УСТРОЙСТВА
Историческая справка: Дренажная хирургия берет свое начало с работ M. Rollett, M. Moreau (1906) и A. Zorab (1912), предложивших имплантировать шелковую нить в склеротомическое отверстие для активации оттока ВГЖ из передней камеры под конъюнктиву. Этот принцип лег в основу дренажной хирургии. Первые дренажные устройства для глаукомы были предложены Molteno и Coll в 1968 году для лечения рефрактерной глаукомы
!!!!Данное оперативное вмешательство показано при неэффективности или бесперспективности применения фистулизирующих операций.
Наиболее часто используемым является клапанное устройство M. Ahmed, которое состоит из трубочки, соединенной с силиконовым клапаном, заключенным в полипропиленовый корпус-резервуар. Силиконовая трубка вводится в переднюю камеру, корпус-резервуар фиксируется эписклерально, формируя заднюю фильтрационную подушку (рисунок 14) [1].

Рисунок 14 – Дренажное устройство M. Ahmed
Ход операции. Корпус – резервуар дренажного устройства крепится эписклерально по меньшей мере в 8 мм от лимба (рисунок 15) [1]. Определяют оптимальную длину дренажной трубки, затем ее укорачивают (необходимо, чтобы она на 2-3 мм заходила в переднюю камеру). Для создания доступа в переднюю камеру параллельно плоскости радужки вводится игла (рисунок 16) [1]. Затем через данный доступ вводится трубка дренажного устройства (рисунок 17) [1].
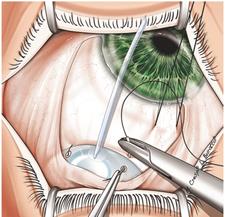
Рисунок15 – Эписклеральная фиксация корпуса- резервуара дренажного устройства
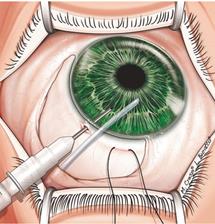
Рисунок 16 – Введение в переднюю камеру иглы для создания доступа
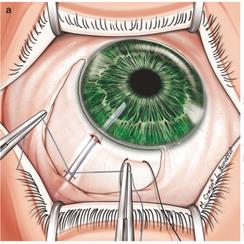
Рисунок 17 – Введение в переднюю камеру силиконовой трубки дренажного устройства
В результате оперативного вмешательства сформирован следующий отток жидкости : передняя камера →силиконовая трубка → эписклеральный клапан-резервуар →субтеноново пространство (рисунок 18) [1].
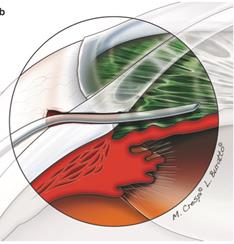
Рисунок 18 – Отток жидкости из передней камеры после имплантации дренажного устройства M. Ahmed
Преимущества дренажа M. Ahmed [19, 20]:
- минимальное вскрытие передней камеры;
- нормотония сразу после имплантации;
- клапанный механизм дренажного устройства обеспечивает поддержание ВГД на оптимальном уровне, препятствуя как гипертонии, так и гиперфильтрации с развитием гипотонии;
- нормотония вне зависимости от положения тела пациента.
Недостатки дренажа M. Ahmed:
Высок риск как интраоперационных, так и послеоперационных осложнений [20]:
- повышение или понижение ВГД;
- мелкая передняя камера;
- хориоидальная отслойка;
- супрахориоидальные геморрагии;
- неправильный ток жидкости;
- гифема;
- миграция имплантата;
- эрозия конъюнктивы;
- катаракта;
- эндофтальмит;
- декомпенсация роговицы;
- диплопия.
Новым направлением хирургического лечения глаукомы является активное внедрение микроинвазивной хирургии с внедрением микродренажей и стентов (iStent, SOLX Gold Micro-Shunt, CyPass) [21,22] . Первое изобретение было предложено в 1998 году - минишунт Ex-PRESS (ExcessivePressureRegulationShuntSystem).
Преимущества микроинвазивной хирургии с внедрением микродренажей и стентов [23]:
- метод прост в выполнении;
- не требуется выполнения иридэктомии;
- методы могут стать альтернативой трабекулэктомии
Недостатки микроинвазивной хирургии с внедрением микродренажей и стентов:
- недостаточно данных об отдаленных результатах оперативного вмешательства [24].
Ⅴ ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ВРОЖДЕННОЙ ГЛАУКОМЫ
Гониотомия и трабекулотомия – операции выбора для лечения врожденной глаукомы.
Принцип:создание прямой связи между передней камерой и каналом Шлемма, минуя главное препятствие для фильтрации водянистой влаги, а именно трабекулы. Операции различаются с точки зрения доступа к шлеммову каналу: ab externo («снаружи») для трабекулотомии и ab interno («изнутри») для гониотомии.
Трабекулотомия.
Ход операции. После формирования склерального лоскута выполняется радиальный разрез склеры в области наружной стенки шлеммова канала (рисунок 19) [1]. Разрез стенки трабекулы осуществляется с помощью трабекулотома (рисунок 20) [1].
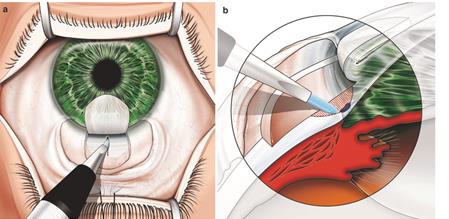
Рисунок 19–Радиальный разрез склеры в области наружной стенки шлеммова канала.
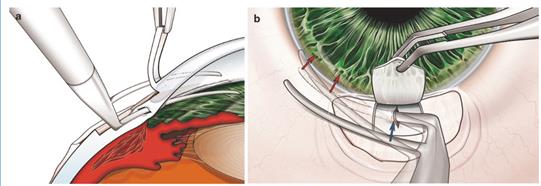
Рисунок 20 – Выполнение разреза стенки трабекулы с помощью трабекулотома, введенного в шлеммов канал
Высок риск развития интра и послеоперационных осложнений:
- повреждение радужной оболочки
- гифема
- гипотония
- передние синехии
Гониотомия.
Ход операции. Принцип оперативного вмешательства аналогичен таковому при трабекулотомии. Однако доступ к трабекуле осуществляется непосредственно изнутри передней камеры. На роговицу помещается специальная гониолинза, позволяющая хирургу визуализировать трабекулярный аппарат угла передней камеры. Через парацентез в переднюю камеру вводится гониотомический интрумент или игла, наконечником инструмента трабекула удаляется (рисунок 21) [1].
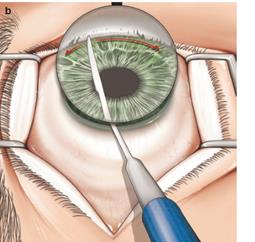
Рисунок 21 – Гониотомия. Через парацентез в переднюю камеру введен гониотомический инструмент. Стрелкой показан ход движения инструмента при удалении трабекулы.
В связи с технической сложностью выполнения оперативного вмешательства возможны осложнения:
- гифема,
- передние синехии,
- катаракта,
Высок риск возникновения таких ятрогенных осложнений как иридодиализ, циклодиализ
ЗАКЛЮЧЕНИЕ
Хирургическое лечение глаукомы показано при отсутствии гипотензивного эффекта от консервативной терапии и при невозможности или неэффективности проведения лазерной терапии.
Основные требования, предъявляемые к современным операциям - стойкая нормализация офтальмотонуса, стабилизация зрительных функций при минимальном риске осложнений.
В связи с высоким послеоперационным эффектом снижения ВГД «золотым стандартом» хирургического лечения первичной открытоугольной глаукомы остается СТЭ. Разработка неперфорирующих вмешательств позволяет сделать операции менее травматичными, повысить их безопасность и снизить процент осложнений, однако гипотензивный эффект часто бывает непродолжительным.
Выбор относительно того, какую процедуру использовать у пациента, страдающего глаукомой, должен приниматься в каждом конкретном случае индивидуально, и чрезвычайно сложно предложить стандартный протокол лечения.
После оперативного лечения необходимо проведение регулярных исследований, оценивающих ВГД, состояние диска зрительного нерва и полей зрения, так как остается вероятность прогрессирования заболевания даже при нормальных значениях ВГД.
В связи с вышесказанным мы рекомендуем:
А) С целью раннего выявления глаукомы проходить профилактические осмотры у офтальмолога, особенно пациентам в возрасте старше 40 лет (согласно данным литературы заболевание поражает 15-25% всего населения в возрасте старше 40 лет).
Б) Пациентам с установленным диагнозом глаукомы необходимо строго соблюдать медикаментозный глаукомный режим и тщательно контролировать уровень ВГД .
Литература
- Caretti, L. Glaucoma Surgery Treatment and Techniques/L. Buratto, L. Caretti. — Switzerland: Springer International Publishing AG, 2018. — 128 p.
- Cairns, J. E. Trabeculectomy. Preliminary report of a new method / J.E. Cairns// Amer. J. Ophthalmol. – 1968. – Vol. 66, № 4. – Р. 673-679.
- Shaarawy, T. Glaucoma therapy – current issues and controversies. – trabeculectomy – the golden standard/ T. Shaarawy, J. Flammer – London: CRC Press, 2004. – Р. 249.
- Петров, С. Ю. Синустрабекулэктомия: история, терминология, техника / С. Ю. Петров, А. В. Волжанин // Национальный журнал Глаукома. – 2017. – Т. 16, № 2. – С. 82-91.
- Бабушкин, А. Э. О практической ценности профилактической задней склерэктомии при трабекулэктомии / А. Э. Бабушкин/ Вестник офтальмологии. – 1990. – № 4. – С. 6-7.
- Sjarov, N. Filtering trepano-trabeculectomy with sponge-like scar /N. Sjarov, A. Draganska// Klin Monbl Augenheilkd (in German). – 1984. – №1. – P.55–8.
- Combined subconjunctival and subscleral ologen implant insertion in trabeculectomy/ D. Tanuj, S. Amit; M. Saptorshi [et al.]// Eye. –2013. – №27. – P. 889.
- Батманов, Ю.Е. Проблемы современной хирургии глаукомы / Ю.Е. Батманов, В.Ю. Евграфов, Ф.В. Гулиев// Вестник офтальмологии. – 2008. – № 4. – С. 53-55.
- Басинский, С.Н. Частота осложнений и сравнительная эффективность хирургического лечения первичной открытоугольной глаукомы /С.Н. Басинский// Клиническая офтальмология. – 2011. – № 2. – С. 67-70.
- Синусотрабекулоэктомия с имплантацией амниотической мембраны при рефрактерной глаукоме/ Г.В. Вашкевич, Т.А. Имшенецкая, Г.В. Ситник [ и др.] //РМЖ «Клиническая Офтальмология» . – 2010. – №3. – с. 90
- Trabeculectomy vs. nonpenetrating trabeculectomy: a retrospective study of two procedures in phakic patients with glaucoma /T.J. Zimmerman, K.S. Kooner, V.J. Ford [et al.]// Ophthalmic Surg . – 1984. – №15. – Р.734–740.
- Stegmann, R. Viscocanalostomy for open-angle glaucoma in African patients. /R. Stegmann, A. Pienaar, D. Miller// J Cataract Refract Surg. – 1999. – №25. – P. 316–322.
- Hayashi, K. Факторы риска неконтролируемого подъема уровня внутриглазного давления после проведения факовискоканалостомии/ K. Hayashi, M. , Park H. Takahashi //Новое в офтальмологии. – 2009. – № 2. – С.9
- Федоров, С.Н. Антиглаукоматозная операция – глубокая склерэктомия /C. Н. Федоров, Д. И. Иоффе, Т. И. Ронкина// Вестник офтальмологии. – 1982. – № 4. – С. 6-10.
- Sclerectomy with collagen/ V.I. Kozlov, S. N. Bagrov, S. Y. Anisimova [et al.]// Eye Microsurg. – 1990. – №3. – P.44–46
- Smith, R. A new technique for opening the canal of Schlemm / R. Smith// Br J Ophthalmol. – 1960. – №44. – P. 370–373.
- Бикбов, М.М. Каналопластика при глаукоме: хирургическая техника и результаты / М.М. Бикбов// РМЖ «Клиническая Офтальмология» . – 2014. – №2. – C. 78.
- Прокофьева, М.И. Современные хирургические подходы к лечению рефрактерной глаукомы (обзор литературы)/ М.И. Прокофьева// Русский медицинский журнал. Клиническая офтальмология.– 2010. – №11. – С. 104-108.
- Тахчиди, Х. П. Сравнительная оценка шунтовых дренажей, доступных в России, в лечении рефрактерной глаукомы /Х.П. Тахчиди, С.А. Метаев, П. Ю. Чеглаков// Глаукома. . – 2008. – №1. – C.52-54.
- Дуглас, Дж. Ри Глаукома/ Дж. Р. Дуглас; под ред. С. Э. Аветисова, В. П. Еричева. – М.: ГЭОТАР-Медиа, 2010. – 472 с.
- Efficacy and safety of gold micro shunt implantation to the supraciliary space in patients with glaucoma: a pilot study /S. Melamed, G.J. Ben Simon, M. Goldenfeld [et al.]// Arch. Ophthalmol. – 2009. – №3. – Р.264-269.
- Early postoperative safety and surgical outcomes after implantation of a suprachoroidal micro-stent for the treatment of open-angle glaucoma concomitant with cataract surgery/ H. Hoeh, I Ahmed, S. Greisanti// J. Cataract. Refract, Surg . – 2013. –№ 39. – P. 431-437.
- Еричев, В.П. Эффективность и безопасность микрошунтирования в хирургии первичной глаукомы.// В.П. Еричев, Г.К. Асратян //Глаукома.– 2012. – №4. – P. 50-54.
- Comparative effectiveness of treatments for open-angle glaucoma: a systematic review for the U.S. / M. V. Boland, A. M. Ervin, D.S. Friedman [et al.]// Preventive Services Task Force. Ann. Intern. Med. – 2013. – №158 . – Р. 271-279.